Es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.

*Estructura del átomo
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleón, alrededor del cual se encuentra una nube de electrones de carga negativa.

El Núcleo Atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 Kg. y una masa 1837 veces mayor que la del electrón.
Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10-27 Kg.)
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidos en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico.
Interacciones eléctricas entre protones y electrones
Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positivamente rodeada de una nube de carga negativa.
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas.
Nube electrónica
Alrededor del núcleo se encuentran los electrones que son partículas elementales de carga negativa igual a una carga elemental y con una masa de 9,10 × 10–31 Kg.
La cantidad de electrones de un átomo en su estado basal es igual a la cantidad de protones que contiene en el núcleo, es decir, al número atómico, por lo que un átomo en estas condiciones tiene una carga eléctrica neta igual a 0.
A diferencia de los nucleones, un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un ion Nube electrónica
Dimensiones atómicas.
La mayor parte de la masa de un átomo se concentra en el núcleo, formado por los protones y los neutrones, ambos conocidos como nucleones, los cuales son 1836 y 1838 veces más pesados que el electrón respectivamente.
Historia del Átomo
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo no como algo controlado por los dioses y manejado a su capricho, sino como una inmensa máquina gobernada por una leyes fijas e inmutables que el hombre podía llegar a comprender. Fue esta corriente de pensamiento la que puso las bases de la matemática y las ciencias experimentales.
Demócrito, uno de estos pensadores griego, en al siglo IV antes de Cristo, se interrogó sobre la divisibilidad de la materia. A simple vista las sustancias son continuas y se pueden dividir. ¿Es posible dividir una sustancia indefinidamente? Demócrito pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más; a esas partículas las denominó átomos, que en griego significa indivisible. Cada elemento tenía un átomo con unas propiedades y forma específicas, distintas de las de los átomos de los otros elementos.

Evolución del Modelo Atómico
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas.
Modelo de Dalton
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. Este primer modelo atómico postulaba:
La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
Los átomos de los diferentes elementos tienen pesos diferentes.
Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
Los átomos, al combinarse para formar compuestos guardan relaciones simples.
Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. radiaciones.
Modelo de Rutherford
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría.
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
“El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en orbitas bien definidas.” Las orbitas están cuantizadas (los e- pueden estar solo en ciertas orbitas)
Cada orbita tiene una energía asociada. La más externa es la de mayor energía.
Los electrones no radian energía (luz) mientras permanezcan en orbitas estables.
Los electrones pueden saltar de una a otra orbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada orbita.
Características del átomo
La curiosidad acerca del tamaño y masa del átomo atrajo a cientos de científicos durante un largo periodo en el que la falta de instrumentos y técnicas apropiadas impidió obtener respuestas satisfactorias. Posteriormente se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y masa de los diferentes átomos. El átomo más ligero, el de hidrógeno, tiene un diámetro de aproximadamente 10-10 m (0,0000000001 m) y una masa alrededor de 1,7 × 10-27 kg (la fracción de un kilogramo representada por 17 precedido de 26 ceros y una coma decimal). Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos.

Es como una especie química, que puede ser un átomo o una molécula ya que esta cargada eléctricamente. Esto ha sido gracias a que ha ganado o perdido electrones de su dotación, casi siempre neutra esto se conoce como ionización. Y también acostumbra llamarse molécula libre, cuando se dice de una molécula.

Importancia del Átomo
El átomo es importante porque es la esencia de las cosas. Gracias al átomo podemos mezclar algunas sustancias y automáticamente otras ya están mezclados formando la tierra, el agua, el fuego y el viento.
También los humanos, las plantas y los animales están compuestos por átomos y sin ellos no habría vida alguna.
Protón
Es la partícula subatómica que forma parte del núcleo del átomo, este tiene carga + y una masa 1.840 veces mayor a la de un electrón. En un átomo definido el # de protones es igual que los electrones que están en el núcleo y además se les denomina nucleones.
La configuración electrónica
En Química, es el modo en el cual los electrones están ordenados en un átomo. Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
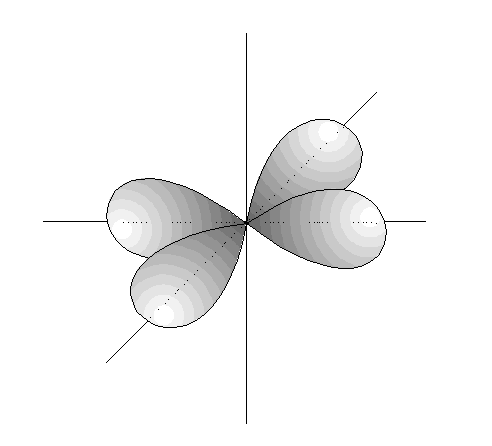
Enlace
La formación de moléculas se generan mediante la unión de átomos que se unen entre si, a este tipo de unión se le conoce enlace, generalmente este tipo de enlaces se da debido a que los átomos de los elementos unidos en estos enlaces son mas estables que los átomos aislados. A la fuerza de atracción que mantiene unidos a los átomos dentro de una molécula o cristal iónico se le llama enlace químicos.
Tipos de enlace
ENLACE IÓNICO.
Ahí, uno de los átomos toma un electrón de la capa de valencia del otro, quedando el primero con carga negativa por el electrón adicional y el segundo con carga positiva al perderlo; el enlace se debe a una ley de la física ampliamente conocida: los polos opuestos se atraen.
Cuando un átomo o molécula tiene carga eléctrica se le conoce como ión, de aquí el nombre. Además se forma cuando la desigualdad de electronegatividad entre 2 átomos es muy grande.
Este enlace se forma cuando la diferencia de electronegatividad entre los 2 átomos es muy grande, es decir, se encuentran en extremos opuestos de la tabla periódica. El elemento más electronegativo se lleva al electrón y el menos electronegativo lo pierde. Comúnmente uno de ellos suele ser el oxígeno o algún halógeno y el otro es uno de los metales alcalinos (Na, K, Li). A las substancias con este tipo de enlace se les llama sales.
El átomo de cloro es más electronegativo que el de sodio y se lleva al electrón, quedando con carga negativa. El enlace iónico se representa poniendo la carga positiva y negativa en el átomo que corresponda, por ejemplo: CI
CI
Características del enlace iónico.
*Es un enlace muy fuerte, en solución acuosa suele disociarse obteniéndose los iones que lo forman.
*Las substancias con enlaces iónicos son solubles en solventes polares.
ENLACE COVALENTE.
En este enlace cada uno de los átomos aporta un electrón. Los orbitales de las capas de valencia de ambos átomos se combinan para formar uno solo que contiene a los 2 electrones.
El enlace covalente se representa con una linea recta que une a los 2 átomos, por ejemplo:
O-H
Características del enlace covalente.
*Es muy fuerte y se rompe con dificultad.
*Si la diferencia de electronegatividades entre los 2 átomos es marcada, tenemos un enlace polar y se favorecerá la solubilidad de la substancia en solventes polares.
Ejemplo: un enlace O-H
*Si la diferencia de electronegatividades es poca, tenemos un enlace no polar y se favorecerá la solubilidad de la substancia en solventes no polares. Ejemplo: un enlace C-H o C-C
ENLACE COVALENTE COORDINADO.
En este enlace también se combinan los orbitales de las capas de valencia de ambos átomos para formar uno solo que contiene a los 2 electrones; la diferencia con el anterior es que sólo uno de los átomos aporta los 2 electrones y queda con carga positiva.
El enlace covalente coordinado se representa con una flecha que sale del átomo que cedió el par de electrones:
N->H
Características del enlace covalente coordinado.
Una vez formado es idéntico a los demás enlaces covalentes.
Proceso de oxidación
Los procedimientos avanzados de oxidación (Advanced oxidation processes = AOP) se definen como "aquellos procesos de oxidación que implican la generación de radicales hidroxilo en cantidad suficiente para interaccionar con los compuestos orgánicos del medio". Se trata de una familia de métodos que utilizan la elevada capacidad oxidante de los radicales hidroxilo y que se diferencian entre sí en la forma en la que los generan. Los más comunes utilizan combinaciones de ozono, peróxido de hidrógeno y radiación ultravioleta y fotocatálisis
1 comentario:
ES MUCHA TEORIA, TIENEN QUE SINTETIZAR, CENTRAR LAS IDEAS DE ACUERDO A LO QUE SE AVANZA, DA LA IMPRESIÓN QUE ES COPIAR Y PEGAR
Publicar un comentario