La Materia
Definición:
Todos los cuerpos estan formados por materia, cual sean sus caracteristicas, pero no todos del mismo tipo de materia. Además esta sustancia extensa indivible e impenetrable, puede adoptar toda clase de formas.

Estados de la materia
Sólido: Tienen forma fija. Su volumen no varía practicamente al comprimirlo.
Su estructura es ordenada.

Líquido: Su forma es del recipiente. Su volumen varia poco al comprimirlo. Su estructura es ordenada.
Gaseoso: Su forma es la del recipiente. Al comprimirlos su volumen no varia mucho. Su estructura molecular es desordenada.

Estructura de la materia
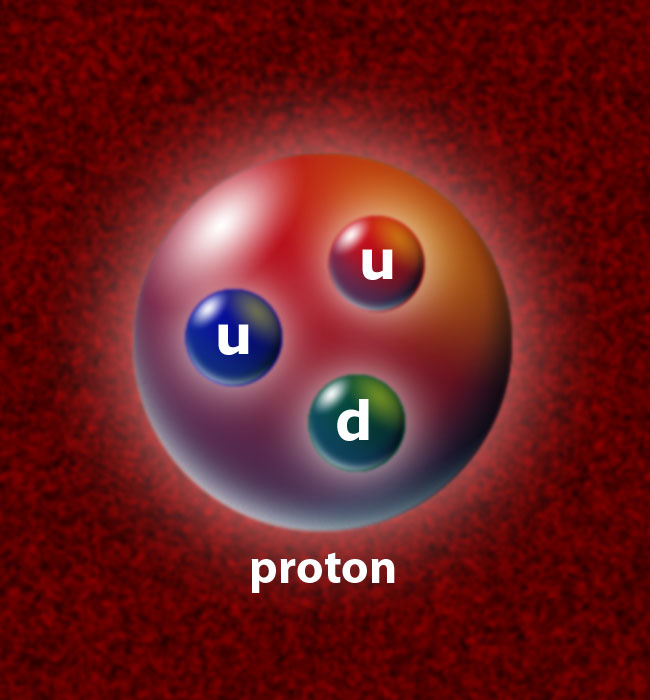
Esta compuesta por átomos. Los cuales poseen determinada estructura. Como podemos ver en el ejemplo:

Cambios de estado de la materia:

(Haga click en las imágenes para verlas más grandes)
Mezclas de la materia:
Para hacer una mezcla tenemos que unir dos o más sustncias. En la naturaleza suelen ir mezclados. Al realizar cualquier mezcla los materiales no se alteran.
Existen dos tipos:
Homogéneos: Su apariencia es igual en toda la mezcla y tiene toda ella igual composición. Ejemplos: La azúcar disuelta en agua.
Heterogéneas: Su apariencia no es igual y en proceso de la mezcla, las propiedades son distintas. Ejemplo: Sal con arena.
Compuesto de materia
Cuando dos elementos o más para formar un compuesto, ocurre un intercambio de energía. Avecez se emite calor. La luz y el gas tambien son productos de la unión de elementos para formar compuestos.
Ejemplos: Una explosión es el efecto secundario de la formación de nuevas sustancias, como cuando se detona la dinamita.
Ciclos biogeoquimicos
Procesos naturales que reciclan factores en distintas formas químicas desde el medio ambiente hacia los organismos, y luego a la inversa.
Los elementos que recorren estos ciclos son: Agua, carbón, oxígeno, nitrógeno, fósforo, y otros. Así llegan a conectar los componentes vivos y no vivos de la Tierra.
¿Cómo es el ciclo del agua?
Es el movimiento de las aguas de la Tierra, que consiste en recoger, purificar y distribuir el suministro fijo del agua en la superficie terrestre, abarcando algunos pasos importantes:
*A través de la evaporación, el agua sobre la tierra y en los océanos se convierte por la energía solar en vapor de agua.
*A través de la condensación, el vapor de agua se convierte en gotas del líquido, las cuales forman las nubes o la niebla.
*En el proceso de precipitación, el agua regresa a la Tierra bajo la forma de rocío, de lluvia, granizo o nieve.
*A través de la transpiración, el agua es absorbida por las raíces de las plantas, pasa a través de los tallos y de otras estructuras y es liberada a través de sus hojas como vapor de agua.
*El agua se mueve desde la tierra hacia el mar, o bien desde la tierra hacia el suelo donde es almacenada y de donde regresa eventualmente a la superficie o a lagos, arroyos y océanos.

(Haga click en las imágenes para verlas más grandes)
¿Cómo es el ciclo del carbono?
Es el componente principal para los seres vivos, además hay dióxido de carbono en la atmósfera, en los océanos y en los combustibles fósiles almacenados bajo la superficie de la Tierra. Los pasos más importantes del ciclo del carbono son los siguientes:
*El dióxido de carbono en la atmósfera es absorbido por las plantas y convertido en azúcar, por el proceso de fotosíntesis.
*Los animales comen plantas y al descomponer los azúcares dejan salir carbono a la atmósfera, los océanos o el suelo.
*Otros organismos descomponen las plantas muertas y las materias animales, devolviendo carbono al medio ambiente.
*El carbono también se intercambia entre los océanos y la atmósfera. Esto sucede en ambos sentidos en la interacción entre el aire y el agua.

(Haga click en las imágenes para verlas más grandes)
Fluido
Es una sstancia o medio continuo que se deforma continuamenteen el tiempo ante la aplicación de una solicitación o tensión tangencial sin importar la magnitud de esta.
Características del fluido
La posición relativa de sus moléculas puede cambiar continuamente.
Todos los fluidos son compresibles en cierto grado.
Tienen viscosidad.
Su viscosidad es independiente de la densidad.

Condensación
Al proceso físico que consiste en el paso de una sustancia en forma gaseosa o forma líquida.
Ejemplos de condesación
La Niebla: Se convierte en lluvia ligera.
Dioxido de carbono: Bajo presión, se condensa, para almacenarlo como líquido en tanques especiales.
El Propano: Se condensa bajo presión, para usarlo en los tambos de las estufas en las cosinas.

Tensión
Puede referirse a:
Tensión mecánica (En la ingeneria) : Es la fuerza interna que actúa por unidad de superficie.
Tensión superficial (En la física) : Hace que la superficie de un líquido se comporte como una película elática.
Tensión elétrica: Es la diferencia de potencial eléctrico entre dos puntos de un circuito, en cíencias de la salud, a la tensión psiológica que se la conoce como estrés.
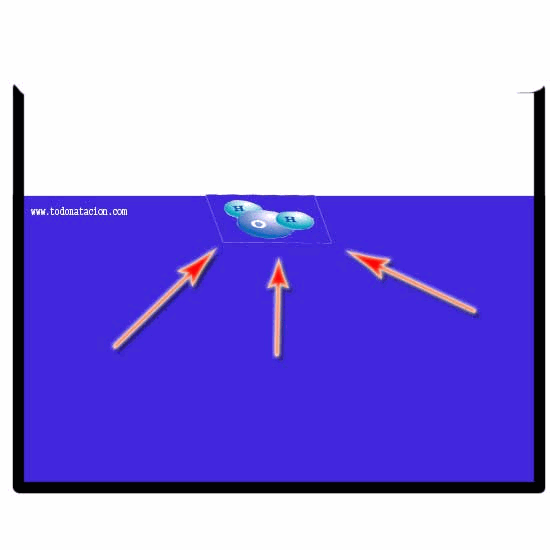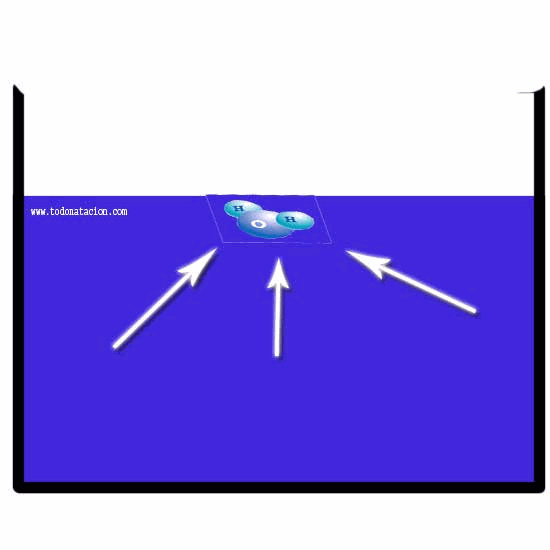
Presión
Tambien llamada presión absoluta se utiliza en aquellos casos que es necesario evítar interpretaciones ambiguas.
Elongación
Puede referirse a:
Enlongación (en la fisica): Es el aumento de la longitud de un muelle al someterlo a una fuerza.
Elongación (en la medicina): Es el aumento accidental de la longitud de un miembro o un nervio, y la lesión producida por ese alargamiento.
Enlongación (en la astronomía): Es el ángulo entre el sol y un planeta visto desde la tierra.
Elongación: Alargamiento que sufre un cuerpo que se comete a esfuerzo de tracción.

Gravedad
Denominada también fuerza gravitatoria, fuerza de gravedad, interacción gravitatoria o gravitación, es la fuerza que experimentan entre si los objetos con masa.

Plasticidad
Es la propiedad mecánica de un material, biológico o de otro tipo, de deformarse permanentemente e irreversiblemente cuando se encuentra sometido a tensiones por encima de su rango elástico.


 ¿Qué es el símbolo?
¿Qué es el símbolo? ¿Qué es el peso atómico?
¿Qué es el peso atómico?









 CI
CI











